Funciones Químicas Inorganicas
|
Fórmulas e información |
Una fórmula es la representación abreviada de una molécula, y en una primera aproximación nos dice qué átomos la integran y en qué proporción se combinan.
Ejemplos:

|
Además de esto, a la vista de la fórmula de un compuesto, podemos saber:
- El tipo de enlace existente entre los átomos (covalente si se enlazan no metales, iónico si aparecen enlazados metales y no metales).
- La masa de la molécula (determinando la masa molecular de la misma).
- La composición centesimal del compuesto.
- La masa de un mol de moléculas (masa molecular expresada en gramos)
Si el compuesto representado por la fórmula es un compuesto iónico (p.ej. el Na Cl) debemos tener en cuenta que no es correcto hablar de molécula ya que es típico de estos compuestos, debido a la naturaleza del enlace iónico, formar grandes agregados o macromoléculas. En estos casos la fórmula nos indicará los iones que integran el compuesto y la relación en que se encuentran combinados. Por ejemplo, la fórmula del NaCl nos indica que existen igual número de iones Cl- que de iones Na +.
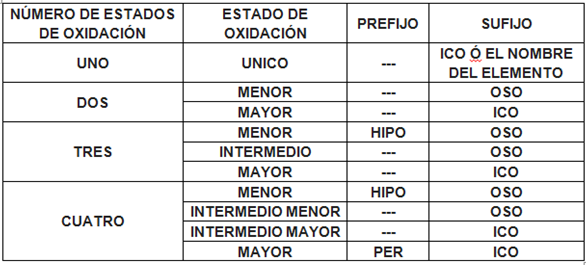
Una de las primeras cosas con que nos encontramos cuando aprendemos a escribir-nombrar fórmulas químicas es una tabla con los estados de oxidación más usuales de los elementos, que consiste en un conjunto de números positivos y negativos asociados a cada elemento. ¿Qué son?. ¿Para qué sirven?
Los números de oxidación nos hablan de electrones que el elemento comparte en los enlaces covalente, o que transfiere (toma o cede) en los compuestos iónicos.
El sentido, tanto del número como del signo, es claro en los compuestos iónicos:
Signo negativo indica que el elemento capta electrones y el dígito, el número de electrones captados. Así, estado de oxidación – 1 significa que el elemento capta un electrón. Estado de oxidación -2, que capta dos electrones…
Signo positivo indica que el elemento cede electrones y el dígito, el número de electrones cedidos. Así, estado de oxidación + 1 significa que el elemento cede un electrón, + 2 que cede dos electrones…
En los compuestos covalentes la interpretación, aunque parecida, no es la misma ya que en estos enlaces se comparten electrones.
Supongamos un enlace covalente entre un hidrógeno y un oxígeno. Éste es más electronegativo, por lo cual tirará más el par electrónico, quedando con cierta carga negativa (ver más arriba). Si tenemos esto en cuenta podemos repartir los electrones de enlace, asignando los dos del par al elemento más electronegativo. De esta manera, el oxigeno en la molécula de agua quedará con 8 electrones (dos más de los que tiene si no está combinado, los correspondientes a los dos hidrógenos que se enlazan). Le asignaremos, por tanto, un estado de oxidación -2. Cada uno de los hidrógenos, sin embargo, quedará sin el único electrón que tiene (ya que se asigna al oxígeno por ser más electronegativo). Su estado de oxidación será, por tanto, +1.
|
Números o estados de oxidación
TALLER DE CÁLCULO DE NÚMEROS DE OXIDACIÓN
I. Escriba los estados de oxidación de los elementos que conforman las siguientes fórmulas:
1. Al(OH)3
2. SO3
3. NH3
4. (Cr2O7)-2
5. H2O2
6. KMnO4
7. (HSO4)-1
8. Sn(CO3)2
9. (NH4)+1
10. LiAlH4
TIPOS DE NOMENCLATURA

CO2 =di--oxido de -carbono = dióxido de carbono
Cl2O7 = hepta--óxido de di--cloro =heptaóxido de dicloro
FeH3 =tri--hidruro de -hierro =trihidruro de hierro
H2Se =mono--seleniuro de di--hidrógeno =monoseleniuro de dihidrógeno
NaOH =mono--hidróxido de -sodio =monohidróxido de sodio
Pb(OH)4 =tetra--hidróxido de -plomo =tetrahidróxido de plomo
NOMENCLATURA STOCK
Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos el número de oxidación del elemento con “nombre específico” anteponiendo a este número, encerrado entre paréntesis, se escribe el nombre genérico y el específico del compuesto de esta forma: función química + de + nombre del elemento específico + el No. oxidación.
Cu2O Óxido de Cobre (I)
CuO Oxido de Cobre (II)
PbO2 Oxido de plomo (IV)
CaO Oxido de Calcio
I2O7 Oxido de Iodo (VII)
Cl2O Oxido de Cloro (I)
Cl2O3 Oxido de Cloro (III)
Cl2O5 Oxido de Cloro (V)
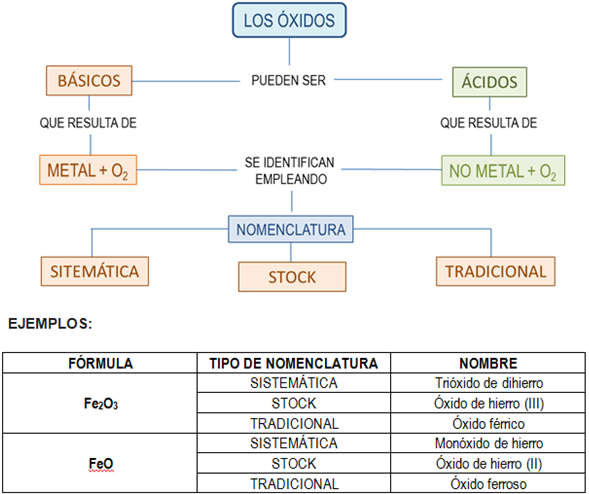
NOMENCLATURA TRADICIONAL (IUPAC), CLÁSICA O FUNCIONAL
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos griegos.
FeO, óxido ferroso
Fe2O3, óxido férrico
Mn2O7, óxido permangánico
Na2O, óxido de sodio.
SO, Anhídrido hiposulfuroso
SO2, Anhídrido sulfuroso
SO3, Anhídrido sulfúrico
Taller Nemenclatura Quimica
1. escribir los nombres según los tres tipos de nomenclatura:
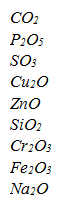
2. Escribir la formula para:

FUNCIÓN QUÍMICA Y GRUPO FUNCIONAL